金沢医科大学 高齢医学科 臨床准教授
小野太輔 先生
筑波大学国際統合睡眠医科学研究機構 教授
神林崇 先生
スポンサーリンク
加齢に伴い、睡眠の質は変化する
睡眠は、大きく「レム睡眠」と「ノンレム睡眠」の2つに分けられます。
レム睡眠時には大脳が活発に働き、記憶の整理や定着が行われていると考えられています。
一方で、ノンレム睡眠時には大脳は休息しており、疲労回復の役割を担っていると考えられています(*1 神林崇,藤原正明, 2021)。
古典的には、ノンレム睡眠はStage1からStage4の4段階に分けられ、Stage1とStage2は“浅い”ノンレム睡眠、Stage3とStage4は“深い”ノンレム睡眠とされています。
深いノンレム睡眠は、睡眠脳波の周波数が低いことから「徐波睡眠」と呼ばれます。
近年では、このStage3とStage4を徐波睡眠段階として一つにまとめ、ノンレム睡眠を3段階に分けることが多くなっています。
加齢に伴い、一般的には下記のように
- ①就床・離床時刻が早くなり、
- ②夜中に何度も目が覚める中途覚醒が増加し、
- ③総睡眠時間が短縮して睡眠効率(総睡眠時間を就床時間で割った値)
が低下するなど、睡眠の量的・質的な低下が生じることが知られています(*2 Mishima, 2015)。
①就床・離床時刻の前進
加齢に伴って少しずつ寝る時間・起きる時刻が早くなり、いわゆる早寝早起きになります。
②中途覚醒の増加
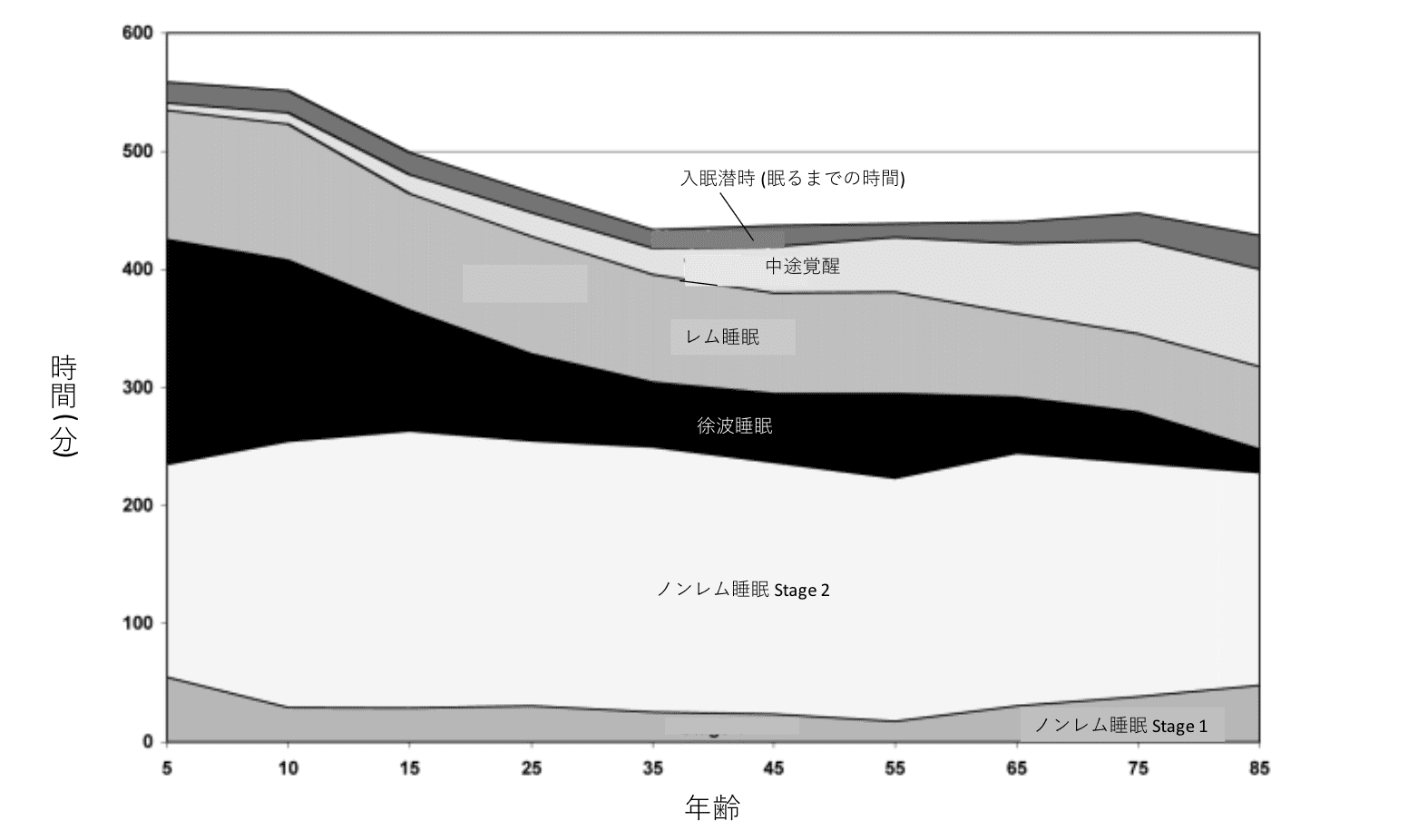
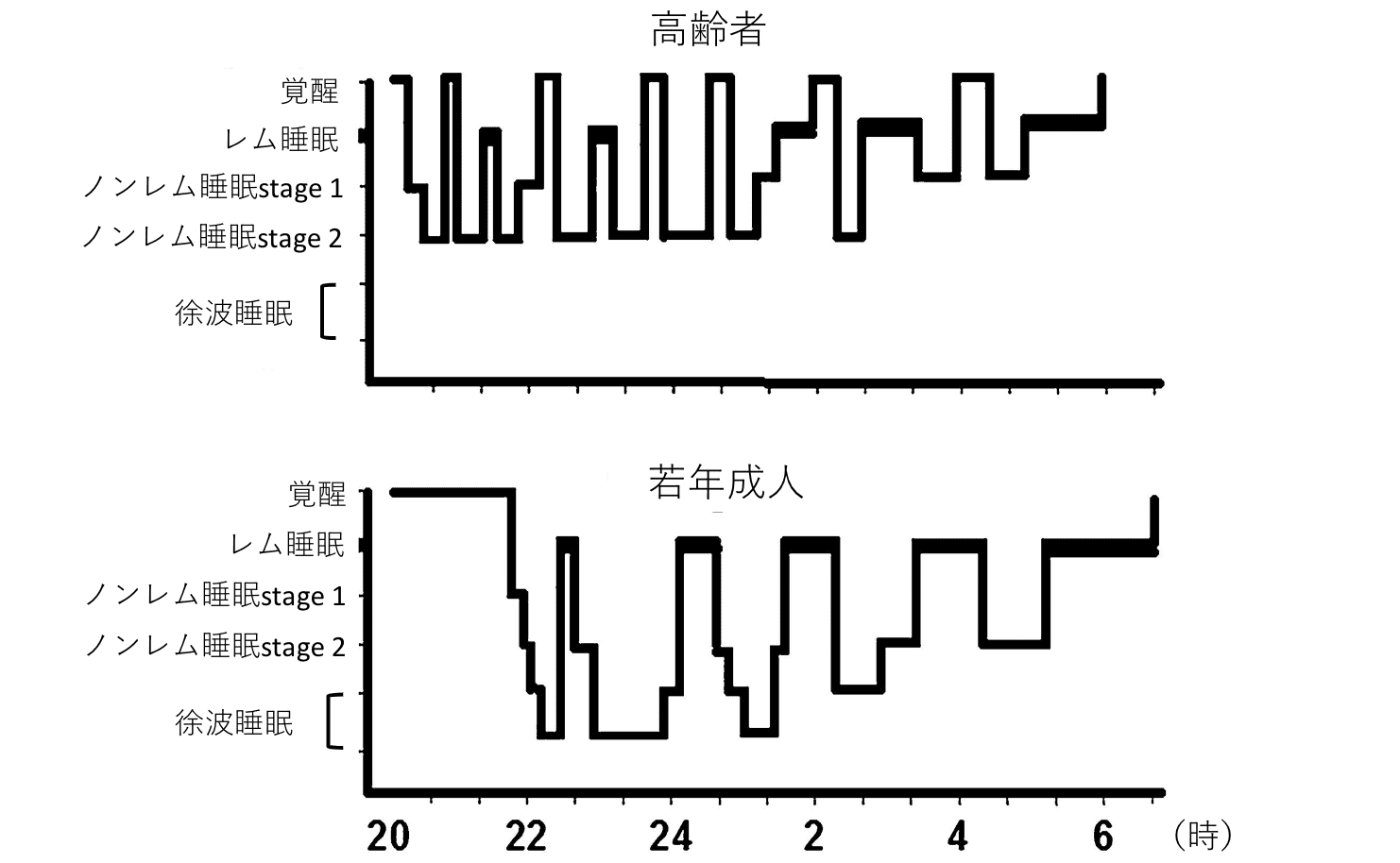
加齢に伴って徐波睡眠 (深いノンレム睡眠) が減少し、結果として睡眠が浅くなり、中途覚醒がみられることが多くなります([図1][図2]参照)。
[図1]ノンレム睡眠Stage1、Stage2、徐波睡眠、レム睡眠、中途覚醒、および入眠潜時の年齢に関連する傾向(*3 Ohayon et al., 2004)
[図2]若年成人および高齢者の睡眠構造(*4 Gulia and Kumar, 2018)
③総睡眠時間の短縮・睡眠効率の低下
高齢者においては、一般的に睡眠時間が短縮する一方で、就床時間が延長するため、睡眠効率は低下します。
若年者の睡眠効率が通常90%を超えるのに対し、65歳以上の高齢者では、睡眠効率が80%以下にまで低下することが多くなります(*2 Mishima, 2015)。
スポンサーリンク
睡眠不足は、アルツハイマー型認知症のリスクに影響する
アルツハイマー型認知症は、日本を含め、世界的に最も多いタイプの認知症です。
典型的には記銘力障害(新しく覚えた記憶を維持できない)から発症し、進行とともに、言語機能の障害なども出現します。
さらに進行すると、被害妄想、興奮、昼夜逆転、せん妄、失禁、徘徊などが見られるようになります。
なぜアルツハイマー型認知症になるのか、その原因はいまだ不明ですが、アミロイドβ(ベータ)タンパク質や微小管結合タンパク質(タウ)などが脳内に沈着し、脳神経細胞が障害されるためと考えられています (アミロイド仮説) 。
現時点で、アルツハイマー型認知症の根治療法は存在せず、アミロイド仮説に基づいて、アミロイドβおよびタウが脳内に沈着することを防ぐ治療法の開発が進められています。
そして実は、このアミロイドβは睡眠と深い関係があります。
アミロイドβの濃度は朝に最も低く、夕方から夜にかけてピークとなります(*5 Huang et al., 2012)。
このことから、睡眠中に脳内のアミロイドβが排泄されると考えられています。
また、アミロイドβの濃度は睡眠時間とも関連があり、睡眠時間(特にノンレム睡眠)が短くなるほど、アミロイドβの濃度が高くなります。
このことから、睡眠不足はアミロイドβの排泄を低下させ、アミロイドβの脳内沈着を引き起こすと考えられています。
睡眠中の脳内老廃物の除去について、新たな仮説が注目されている
近年、睡眠中にアミロイドβなどの脳内老廃物を排泄する方法として、「グリンパティックシステム仮説」が提唱されました(*6 Nedergaard, 2013)。
これは、脳内の液体成分が、睡眠中に動脈から静脈の方向に流れて老廃物を押し流し、老廃物ごと静脈に回収された後、リンパ管から排泄されるというものです。
脳神経細胞は「グリア」という細胞によって支えられています。
睡眠中にこのグリア細胞の間隔が広がることによって、脳内の液体成分が60%ほど増加し、流れる量が増加することで、脳内のアミロイドβなどをより効率的に排泄するとされています (*7 Xie et al., 2013)。
このグリンパティックシステムは、マウスなどの齧(げっ)歯(し)類(るい)においてはほぼ確実に存在すると考えられていますが、人間においても同様のシステムが存在するのかについては、明らかになっていません。
また、脳内の老廃物がどのようにしてリンパ管に排泄されるのかも明らかになっておらず (*8 Shindo, 2019)、今後の研究が期待されます。
十分な睡眠時間の確保が、健康増進につながる
ここまで述べてきたとおり、アルツハイマー型認知症の原因は、アミロイドβやタウなどが脳内に沈着し脳神経細胞が障害されるためと考えられていますが、まだ明らかになってはいません。
また、脳内の老廃物を除去すると言われているグリンパティックシステムも、人間においては確認されておらず、仮説の段階です。
しかし、適切な睡眠が何らかの方法で脳内の老廃物を除去することは、ほぼ確実と考えられています。
また、睡眠不足が、認知症をはじめとする各種疾患のリスクを増加させることも明らかになっています。
ただし、必要な睡眠時間は人によって異なります。
また、一般的には加齢に伴って必要な睡眠時間が減少するため、単純に「睡眠時間が短いと認知症のリスクが高まる」というわけではないことは覚えておきましょう。
なお、日中の活動に影響するほどの眠気がなければ、夜間の睡眠時間が短くても、十分な睡眠が取れていると判断できます。
逆に、著しい日中の眠気がある場合は、睡眠不足が考えられます。
十分な睡眠時間を確保し、そのうえで眠気が続く場合は、「過眠症」や「睡眠時無呼吸症候群」などの睡眠疾患の可能性があるため、睡眠外来での精密検査が望まれます。
【参考文献一覧】
(*1)神林崇,藤原正明 2021. 睡眠と老化制御. 抗加齢・老化制御 最新医療/ビジネス総覧.
(*2)MISHIMA, K. 2015. Sleep and sleep disorders in the elderly. Journal of the National Institute of Public Health, 64, 27-32.
(*3)OHAYON, M. M., CARSKADON, M. A., GUILLEMINAULT, C. & VITIELLO, M. V. 2004. Meta-analysis of quantitative sleep parameters from childhood to old age in healthy individuals: developing normative sleep values across the human lifespan. Sleep, 27, 1255-73.
(*4)GULIA, K. K. & KUMAR, V. M. 2018. Sleep disorders in the elderly: a growing challenge. Psychogeriatrics, 18, 155-165.
(*5)HUANG, Y., POTTER, R., SIGURDSON, W., SANTACRUZ, A., SHIH, S., JU, Y. E., KASTEN, T., MORRIS, J. C., MINTUN, M., DUNTLEY, S. & BATEMAN, R. J. 2012. Effects of age and amyloid deposition on Aβ dynamics in the human central nervous system. Arch Neurol, 69, 51-8.
(*6)NEDERGAARD, M. 2013. Neuroscience. Garbage truck of the brain. Science, 340, 1529-30.
(*7)XIE, L., KANG, H., XU, Q., CHEN, M. J., LIAO, Y., THIYAGARAJAN, M., O’DONNELL, J., CHRISTENSEN, D. J., NICHOLSON, C., ILIFF, J. J., TAKANO, T., DEANE, R. & NEDERGAARD, M. 2013. Sleep drives metabolite clearance from the adult brain. Science, 342, 373-7.
(*8)SHINDO, A. 2019. Small vessel disease and Alzheimer’s disease ; the glymphatic pathway in amyloid beta clearance system. Neurological Therapeutics, 36, 524-527.






















